זיהוי חוסר תפקוד של המערכת האנדוקנבינואידית באדם באמצעות בדיקה תורשתית ברוק, בדיקת דם ובדיקת פעילות מוח

כותב המאמר: ד"ר יעקב וקסמן – יועץ מדעי של חברת MOYA-CBD
ד"ר לאימונולוגיה, פוסט דוקקטורנט במעבדה של פרופ' רפאל משולם באוניברסיטה העברית בירושלים.
תוכן עניינים
מבוא
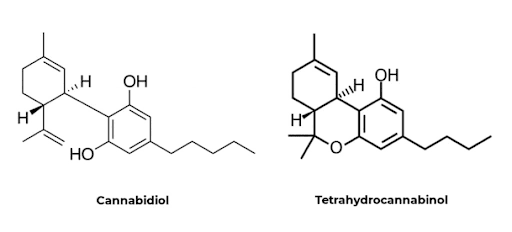
באמצע שנות ה-60, פרופ' רפאל משולם ז"ל וצוות המחקר שלו זיהו, בודדו וסנתזו במעבדה את ה- Tetrahydrocannabinol [THC] המרכיב הפסיכואקטיבי מצמח הקנביס ואת הקנבידיאול Cannabidiol [CBD] שאיננו פסיכואקטיבי ופועל בעיקר על תאי מערכת החיסון להרגעת דלקת. לאחר כשני עשורים, החוקרת אווילין הוואלט מאנגליה גילתה את הקולטן הקנבינואידי CB1 ממוח אדם ובמקביל, החוקר א. מטסודה מיפן גילה את הקולטן הקנבינואיד CB2 (1990). בהמשך המחקר, פרופ' לומיר האנוש ופרופ' וויליאם דוואן ז"ל בשיתוף עם פרופ' רפאל משולם ז"ל גילו את האנדוקנבינואידים שהם קנבינואידים פנימיים.
ה-THC שהוא פיטוקנבינואיד ממקור צמחי (אקסוקנבינואיד) מחקה את פעולתם של האנדוקנבינואידים (למרות הבדלים ניכרים במבנה הכימי שלהם) וגורם להשפעה פסיכואקטיבית, אופורית "HIGH". השם "אננדה" מקורו בשפה ההינדית ומתאר "אושר פנימי".
המערכת האנדוקנבינואידית Endocannabinoid system [ECS] היא מערכת פנימית מרכזית אשר משפיעה על מנעד רחב מאוד של תהליכים ביולוגיים וכימיים בגוף האדם ומהווה גורם מכריע בשמירת הבריאות ובתפקוד התקין של רוב המערכות בגוף. המערכת משפיעה ומווסתת הרבה תהליכים ביולוגיים בגוף, שומרת על תקינותן של המערכות הקיימות בו ומסייעת במניעת מחלות. ה-ECS שומרת ברקמות ובאיברים רבים על שיווי-משקל פנימי (הומיאוסטזיס – היכולת של יצור ביולוגי לשמור על סביבה פנימית יציבה למרות השינויים שחלים בסביבה החיצונית).
ה- ECS מפקחת על: תחושת הכאב, התיאבון והשובע, קצב המטבוליזם, רמת הסוכר בדם, וויסות טמפרטורת הגוף, שליטה מוטורית, ויסות מערכת כלי דם ולב, בנייה ואיחוי של עצמות, בניית שרירים, פיקוח על תפקודי כבד, תפקודי מערכת הרבייה, הזיכרון, הלמידה, מצב-הרוח, השינה ותפקודי מערכת החיסון – בעיקר בשיכוך תהלכים דלקתיים.
כל התהליכים האלה תורמים לאיזון פנימי של הגוף. כאשר מקור חיצוני מפריע לאיזון הפנימי של הגוף, המערכת האנדוקנבינואידית נכנסת לפעולה. הסברה המדעית המקובלת כיום לגבי התפקיד העיקרי של המערכת האנדוקנבינואידית היא שתפקידה לשמור על האיזון הפנימי של הגוף כולו. ה-ECS בנויה מאנדוקנבינואידים Endocannabinoids [eCBs], קולטנים אנדוקנבינואידים CB1 ו- CB2 ומאנזימים שמייצרים או מפרקים את שני הקנבינואידים הפנימיים.
אנדוקנבינואידים endocannabinoid [eCBs] (פנימיים)
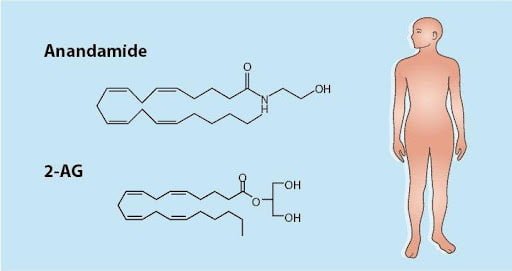
ה-ECS מורכבת משני אנדוקנבינואידים ראשיים – אננדמיד arachidonoyl ethanol amide [AEA] ו-2 ארכידוניל גליצרול [2-AG]. קיימים עוד מספר אנדוקנבינואידים משניים וכולם שליחים עצביים שומניים – בעוד ששאר השליחים העצביים [neurotransmitters] בגופנו מסיסים במים, נאגרים בווזיקולות (בועיות הפרשה) בסינפסות (קצוות) של תאי העצבים ומשוחררים לרווח הסינפטי בצורה מבוקרת. כל השליחים העצביים המסיסים במים עוברים בדיפוזיה בחלל הסינפסה ונקשרים לקולטנים על-פני הממברנה של תאי עצבים אחרים.
האנדוקנבינואידים מקורם בפוספוליפידים מרכיבי ממברנות תאים והם נוצרים ומשוחררים רק כשיש בהם צורך ON DEMAND ולכן מדידת רמות ה- eCBs במחזור הדם של אדם לא מספיקה בכדי לאפיין את רמת הפעילות של ה- ECSשלו. כיום, לא ניתן להגדיר בברור מהי רמה תקינה של אנדוקנבינואידים בדם.
אנדוקנבינואידים נוספים שהתגלו בהמשך הם:
Oleoylethanolamine [OEA] Palmitoylathanolamine [PEA],
N-acylethanolamine [NAEA] והאוליאומיד גורם השינהOleamide [OLA]
חשוב יהיה לבדוק את הרמה של כל האנדוקנבינואידים השונים בדם ובדגימה מנוזל חוט השידרה אצל אנשים שאצלם ה-ECS לא מתפקדת.
קולטני אנדוקנבינואידים
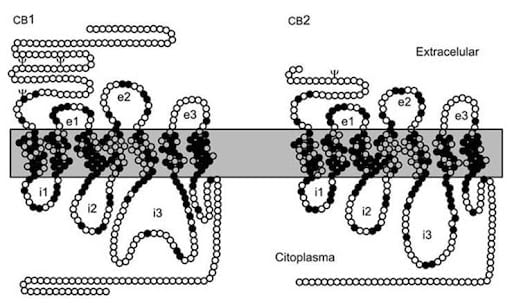
בגוף האדם מצויים שני קולטני אנדוקנבינואידים שהם קולטנים הקשורים לחלבון ג'י G-protein coupled receptor [GPCRs]:
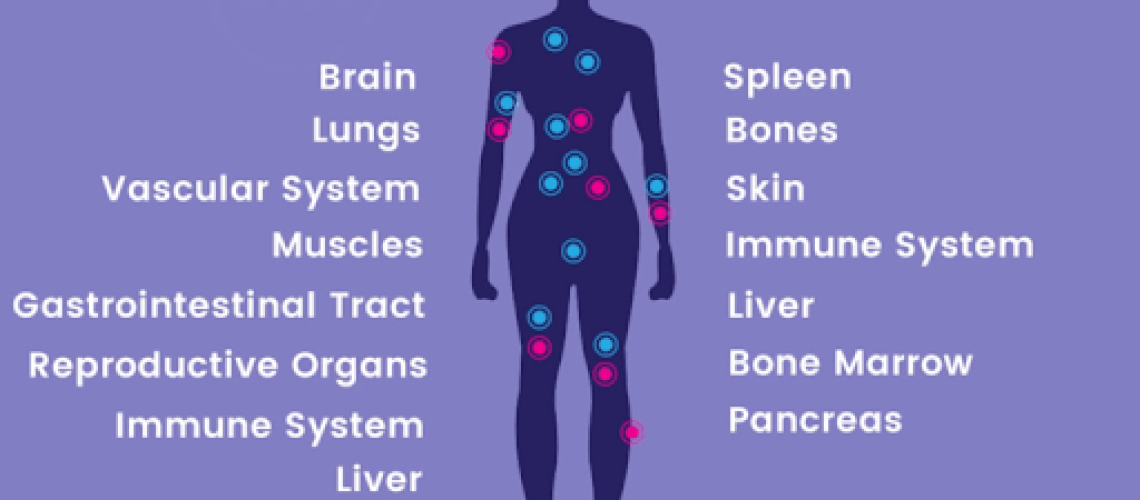
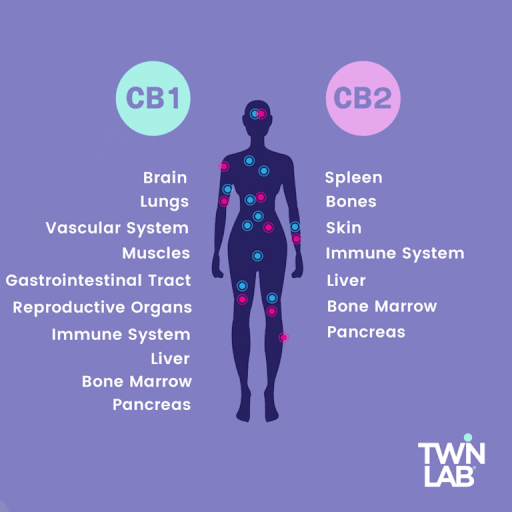
הקולטן המרכזי שנמצא בעיקר במוח ובחוט השידרה (מערכת העצבים המרכזית) נקרא CB1
הקולטן ההיקפי שנמצא בעיקר במערכת העצבים ההיקפית ובמערכת החיסון ונקרא CB2 .
במולקולת CB2 חסרות שרשרות בקצה ה-C (החיצוני) ובקצה ה-N (הפנימי). נובע מכך שה-CB1 נוצר לפני ה- CB2 ואכן במהלך האבולוציה, רק אצל הדגים הופיע הקולטן האנדוקנבינואידי השני בעוד שהקולטן האנדוקנבינואידי הראשון נמצא כבר בכוכב הים הקדום.
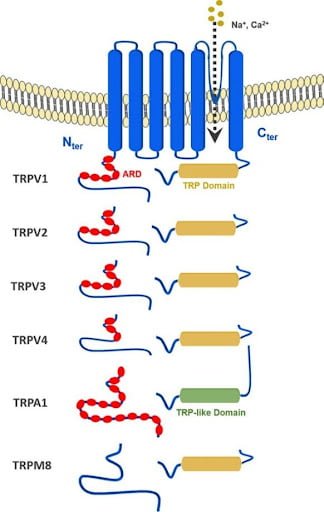
קולטנים נוספים שכנראה קשורים ל-ECS הם תעלות יונים שונות:
Transient receptor potential [TRP] channels
תעלות יוניות מהוות מרכיב חשוב בתהליכים רבים בגוף כמו הולכה עצבית, קצב הלב, הפרשת הורמונים, תנועה של תאים והומאוסטאזיס. תעלות היונים משפיעות על שינוי במתח הממברנה עקב שינוי מאזן היונים משני צידיה ובכך גורמות להפעלה של תעלות או קולטנים אחרים המתווכים תהליך פיזיולוגי.
אופן הפעולה: תעלת היונים מאפשרת מעבר של יונים דרך קרום התא בפעפוע כתוצאה מקיומו של מפל אלקטרוכימי הקובע את כיוון תנועת היונים. קיימים סוגים רבים של תעלות יונים הנבדלות זו מזו בסוג היון אותו הן מסוגלות להעביר ובאופן שבו ניתן להפעיל את התעלה. לולא קיומן של התעלות, יונים כמעט ולא היו יכולים להיכנס לתא או לצאת ממנו בגלל הדו-שכבה הליפידית המרכיבה את קרום התא ומונעת מיונים מומסים במים לעבור דרכה. רוב התעלות היוניות מבוקרות על ידי מנגנונים שונים, על מנת למנוע דליפה לא מבוקרת של היונים. מנגנונים כאלו יכולים להיות מתח ממברנה (כמו בפוטנציאל פעולה) לחץ פיזי, טמפרטורה, חומציות, קישור חלבונים (כמו חלבוני G), קישור חומרים (כמו אצטיל כולין) ועוד.
מבנה: מרכיבי חלבוני התעלה בחלקם הידרופיליים ובחלקם הידרופוביים. החלקים ההידרופיליים נמצאים בשני קצות התעלה והחלק ההידרופובי נמצא במרכז התעלה, כך שמרכז התעלה ממוקם בתוך התווך ההידרופובי של קרום התא, והקצוות פונים אל תוך התא ואל מחוץ לתא שם הנוזלים הידרופיליים.
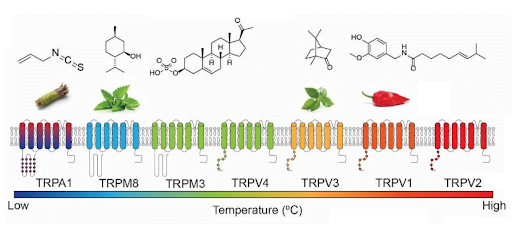
תעלות היונים חשות שינויי טמפרטורה בסביבת הגוף שלנו בתחום שבין 15 ל-43 מעלות צלזיוס והן מגיבות לחומרי טבע נפוצים שונים.
מלבד קפסאיצין מצ'ילי חריף, נמצאו עוד אגוניסטים של תעלת היונים TRPV-1:
CBD, CBG, THCV, CBDV וגם AEA
קנבינואידים מפקחים על פעילות חלק מתעלות היונים ואפשר להתייחס אליהן כקולטנים קנבינואידים יונוטרופיים IONOTROPIC.
אננדמיד הוא אגוניסט של TRPV1 וגם אנטגוניסט של TRPM8 .
THC הוא אגוניסט של TRPV2,3,4 ושל TRPA1 ו- TRPM8.
אנדוקנבינואידים יכולים להקשר לכל אחד מקולטני ה-ECS וההשפעה שמתקבלת תלויה במיקום הקולטן ובסוג האנדוקנבינואיד אשר נקשר אליו. אנדוקנבינואידים כ-AEA או AG-2 יכולים להקשר לקולטן CB1 שבעמוד השדרה ולגרום לתחושה משככת כאב והם יכולים להקשר גם לקולטן CB2 שבתאי מערכת החיסון ולסמן לגוף על מצב דלקתי.
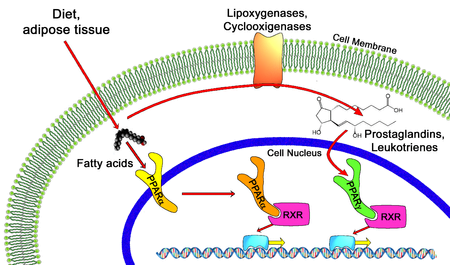
קולטנים נוקלאריים: peroxisome proliferator-activated receptors (PPARs)
הקולטנים PPAR מסוג אלפא קושרים חומצות שומניות מהמזון ואז נכנסים לתוך גרעין התא, נקשרים לגורם השעתוק והקולטן הנוקלארי RXR retinoid X receptor)) וגורמים לשעתוק גנים. הקולטנים מסוג גאמא קושרים פרוסטגלנדינים ולאוקוטריאנים וגם הם נקשרים ל- RXR וגורמים לשעתוק גנים. חומצות שומן הופכות לפרוסטגלנדינים וליאוקוטריאנים על-ידי אנזימים ממברנליים – ליפואוקסיגנז [LOX] וציקלואוקסיגנז [COX]. RXR הוא קולטן נוקלארי שמופעל ע"י חומצה רטינואית ויוצר הטרודימר עם PPAR ומאפשר שעתוק של DNA ל- M-RNA ולחלבון. בכדי לבדוק אם אדם סובל מחסר פעילות של ה-ECS חשוב לבדוק את רמת ההתבטאות של PPAR ו- RXR בתאי הדם השונים.
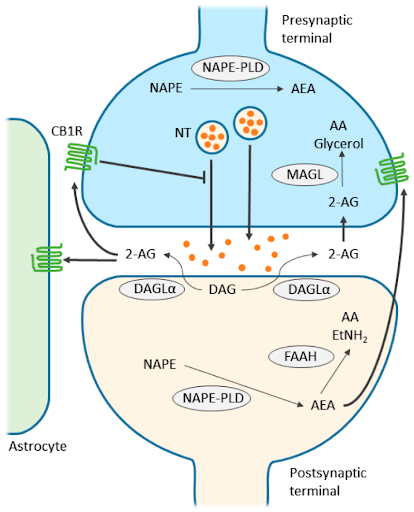
בקרה באיזון חוזר הופכי Retrograde signaling
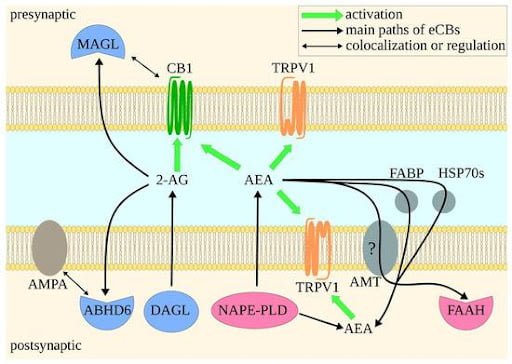
במרבית הסינפסות הכימיות הרגילות, שליח עצבי מסיס במים משוחרר מה- PRESYNAPSE ועובר בדיפוזיה בתוך הרווח הסינפטי אל ה-POSTSYNAPSE ושם הוא נקשר לקולטן מתאים ומפעיל אותו. בסיגנל הופכי (רטרוגרייד), שליחים שומניים משוחררים מהפוסט-סינפסה ונעים דרך הרווח הסינפטי בכיוון ההפוך אל הקולטנים שמבוטאים על-פני קרומיות פרה-סינפטיות. שפעול הקולטנים הפרה-סינפטיים גורם לשינויים (בעיקר ירידה) ברמת השחרור של שליחים עצביים אחרים המסיסים במים. המערכת האנדוקנבינואידית עושה שימוש בהיזון חוזר הופכי כדי לפקח על עצמת שחרור שליחים עצביים שונים מתאי עצבים ובכך משמשת כווסת ומונעת שחרור מוגזם של שליחים עצביים כסרוטונין, דופאמין, אפינפרין, אצטיל-כולין ועוד שעלול להזיק לתאי העצבים.
הפעלת הקולטן CB1 שמבוטא על-פני הממברנה הפרה-סינפטות ע"י אנדוקנבינואידים שנוצרו בפוסט-סינפסה – גורמת להפסקת שחרור עודפי שליחים עצביים [NT] אל הרווח הסינפטי. פירוק ה- AEA מבוצע בפוסט-סינפסה בעוד שפירוק ה- -AG2 מבוצעת בפרה-סינפסה.
האנזימים שאחראים לייצור ולפירוק האנדוקנבינואידים
האנזים אשר מייצר את האננדמיד מפוספוליפידים בקרומיות תאים הוא: N-arachidonyl-phosphatidyl ethanolamine .phospholipase D [NAPE-PLD]
האנזים אשר מייצר 2-AG הוא: Diacyl glycerol lipase [DAGL]
ישנם שני אנזימים עיקריים אשר מפרקים אנדוקנבינואידים:
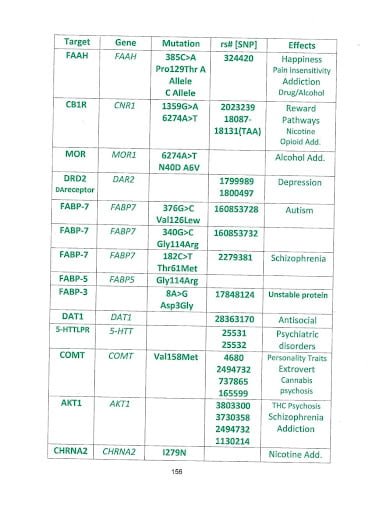
אנזים בשם fatty acid amide hydrolase [FAAH] שאחראי על פירוק של ארכידוניל אתנולאמיד [AEA] לחומצה ארכידונית + אתנולאמין.
אנזים בשם monoacylglycerol lipase [MAGL] שאחראי על פירוק של 2-arachidonoylglyerol לחומצה ארכידונית + גליצרול.
חסר תפקוד של ה-ECS
בעשור האחרון הועלתה השערה שמתקיים מצב של מחסור קליני באנדוקנבינואידים (clinical endocannabinoid deficiency) או בקיצור CECD.ההפרעה מכונה גם endocannabinoid deficiency syndrome [EDS]. על פי תאוריה זו אם רמת האנדוקנבינואידים בגוף נמוכה מידי או שיש בעיה בתפקוד התקין של המערכת האנדוקנבינואידית, הדבר עשוי לגרום להתפתחות מחלות שונות כדוגמת: מיגרנות, פיברומיאלגיה ומחלות מעי דלקתיות [IBS].
לאף אחת מהמחלות הללו אין הסבר ברור מדוע הן נגרמות, קשה לטפל בהן ופעמים רבות הן קיימות בחפיפה אצל אותו אדם.
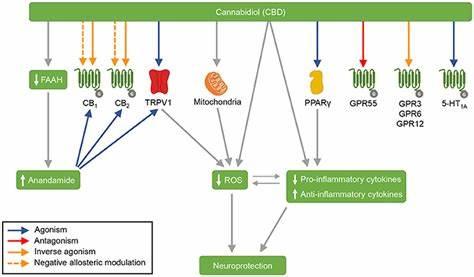
אם אכן המחלות הללו נובעות ממחסור באנדוקנבינואידים, הרי שהתערבות חיצונית אשר תגרום לייצור של אנדוקנבינואידים יכולה לסייע בהתמודדות איתן. קנבידיאול מעכב את האנזים FAAH אשר מפרק אננדמיד ולכן רמתו של האנדוקנבינואיד בדם ובמוח עולה. ה-THC נקשר ומפעיל את שני הקולטנים האנדוקנבינואידים ובכך יכול לטפל בהפרעה.
ברור, שלא לכולם/ן טיפול בפיטוקנבינואידים מועיל ולכן חשוב לאפיין מראש מבחינה תורשתית את הרגישות הביולוגית כלפיהם.
השפעת THC על ה-ECS
THC הוא אחד מהקנבינואידים העיקריים שבצמח הקנאביס והוא זה שאחראי להשפעה הפסיכואקטיבית המאופיינת בתחושת "היי" או "סוטול". כאשר מרכיב ה-THC נמצא בגוף, הוא נקשר לקולטני המערכת באופן הדומה לאנדוקנבינואידים. ה-THC יכול להקשר בזיקה גבוהה גם לקולטני CB1 וגם לקולטני CB2. היכולת של THC להקשר לשני סוגי הקולטנים מאפשרת לו השפעה מאוד רחבה על הגוף והמוח.
חלק מההשפעות הללו הן חיוביות כמו לדוגמה היכולת של THC לשכך כאבים ולעורר תיאבון ומצד שני, עלולות להיות לו גם השפעות שליליות כמו: גרימת תחושות של פרנויה וחרדה במקרים מסוימים. השפעת ה-THC על אדם תלויה בתורשה ולכן חשוב לבדוק בדגימת רוק מוטציות בגנים אשר מקדדים לחלבונים שונים (קולטנים, חלבונים נשאים, אנזימים, גורמי שעתוק ועוד). "תחילה, אל תזיק" הוא מוטו חשוב ברפואה המודרנית עוד מימי היפוקרטס.
לאחרונה התברר שהשער לשימוש בקנביס הוא עישון הטבק בשל מעורבות הקולטן הניקוטיני לאצטיל-כולין. {נספח א' להלן – פירוט של הנושא נמסר לעיונו של עו"ד חץ דויד-עוזר לפני כחצי שנה והוגש לבית המשפט העליון כדי שידון בחוקיות של האיסור הגורף לשימוש בצמח המרפא הטבעי ורדיפת המשתמשים/ות}. כנראה, הסובלים מחסר בפעילות המערכת האנדוקנבינואידית נמשכים לשימוש תכוף בקנביס ומשפרים בכך את איכות חייהם. ללא הסברה מהימנה בגובה העיניים לא ניתן למנוע התחלת שימוש בקנביס בגיל צעיר מידי או במהלך ההיריון וההנקה. סייגים והגבלות אשר מגובים במחקר עדכני ומהימן יתקבלו בציבור וגם בנוער יותר טוב מאכיפה וענישה.
השפעת CBD על ה- ECS
ההשפעה העיקרית של קנבידיאול על ה- ECS נובעת מעיכוב פעילות האנזים FAAH אשר גורמת לעלייה ברמות האננדמיד בדם ובמוח. האננדמיד הוא אגוניסט של שני הקולטנים האנדוקנבינואידים וגם של תעלת היונים TRPV1. קנבידיאול בעצמו הוא אגוניסט של אותה תעלת יונים ולכן חשוב לבדוק את ההתבטאות של תעלת היונים הזאת על-פני לימפוציטים מהדם. קנבידיאול גם נקשר ומפעיל (משמש כאגוניסט) את הקולטן לסרוטונין [5-HydroxyTryptamine] מטיפוס A1.
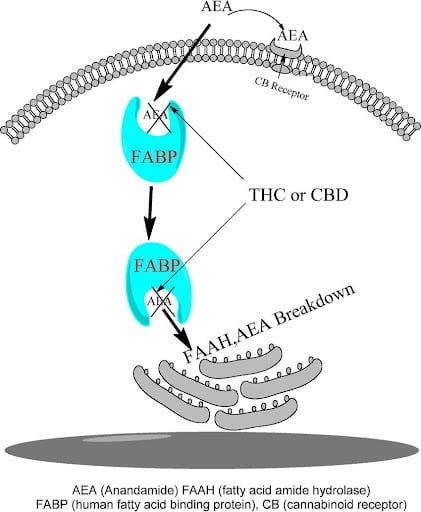
במקביל, קנבידיאול מפעיל את הקולטן הנוקלארי PPAR-gamma ובכך מדכא דלקות. הורדת ייצור רדיקלים חופשיים של חמצן (ROS) במיטוכונדריות של התאים בהשפעת CBD מגוננת על מערכת העצבים כולה מניוון. לאחרונה התברר שעיכוב פעולת ה- FAAH נובעת מתחרות של CBD או THC על אתרי הקשירה של חלבונים נשאים של חומצות שומן fatty acid binding proteins [FABPs] אשר מעבירים אננדמיד מהממברנה דרך הציטוזול הנוזלי אל הרטיקולום האנדופלזמטי [ER] בסמוך לגרעין התא, למקום שבו נמצא ופועל האנזים FAAH. פיטוקנבינואידים נקשרים לאתר הפעיל של FABP ומונעים העברת AEA מהממברנה אל ה-ER.
טרנספורטר ממברנלי של אננדמיד : [AMT] anandamide membrane transporter
אננדמיד נמס בשומן ולכן עובר בחופשיות את ממברנות התאים הפרה-סינפטי והפוסט-סינפטי. אבל כדי לנוע בציטופלזמה המימית, אננדמיד חייב להיקשר לחלבון נשא: HSP70, FABP ו- AMT. הקולטן CB1 והחלבון הנשא AMT תלויים בתכולת הכולסטרול בממברנות. תרופות להורדת רמת הכולסטרול בדם גורמות לדיכאון, אלימות ואובדנות. הפעלת CB1 מעוררת את פעולת AMT דרך עלייה ברמות ה- NITRIC OXIDE [NO]. מהצד האחר, פעילות AMT נבלמת על-ידי הפעלת CB2אשר מורידה את שחרור NO.
בדיקה תורשתית בדגימת רוק
מחקרים בתחום הגנטיקה ההתנהגותית מראים שלא ניתן להתעלם מגורמים תורשתיים שמשפיעים על ההתנהגות. מאמר סיכום של דר' רוברט פלומין, אחד ממייסדי התחום, מסכם את עשרת הממצאים החזקים בגנטיקה התנהגותית. פלומין טוען שלכל התכונות הפסיכולוגיות יש בסיס גנטי חזק, אך הוא לעולם לא מגיע ל-100%. הוא טוען שההשפעה התורשתית היא תולדה של הרבה גנים בעלי השפעה קטנה. הוא הראה שההשפעה התורשתית על אינטליגנציה הולכת וגדלה! עם העלייה בגיל. הוא הראה גם שרוב ההשפעה הסביבתית על התנהגות נובעת מחויות ייחודיות לאדם, ולא מחוויות המשותפות לו ולאחיו.
בשנת 2015 סיכם מחקר מטא-אנליזה את כל מחקרי התאומים שבדקו את מידת התורשתיות של תכונות אנושיות שונות. המחקר כלל מידע מכ־2,750 מאמרים, על כ־14.5 מיליון זוגות תאומים, שבדקו כ־18,000 תכונות מתחומי הרפואה, הביולוגיה והפסיכולוגיה. מקדם התורשתיות הממוצע היה 49%.
450 מחקרים בתחום הקוגניטיבי הראו מקדם תורשתיות של 57% – 1,778 מחקרים בתחום הפסיכיאטרי הראו מקדם תורשתיות של 62%, ו-45 מחקרים בתחום של ערכים חברתיים הראה מקדם תורשתיות של 69%. החל מסוף המאה ה-20, התפתח תחום מחקר בשם אפיגנטיקה החוקר איך מנגנונים מולקולריים לא גנטיים מווסתים ביטוי גנטי. תחום זה תרם להבנה שלא ניתן להפריד בין התורשה לסביבה. התחום החוקר את יחסי הגומלין בין התורשה לסביבה הוליד מודלים תאורטיים וממצאים מחקריים רבים.
פולימורפיזם תורשתי
פולימורפיזם – מיוונית "רב-צורתיות" – מתאר מספר מצבים אפשריים לתכונה מסוימת. פולימורפיזם – מושג ביולוגי המתאר את התופעה שאללים רבים של אותו גן בתוך אוכלוסייה, מבוטאים בפנוטיפים שונים.
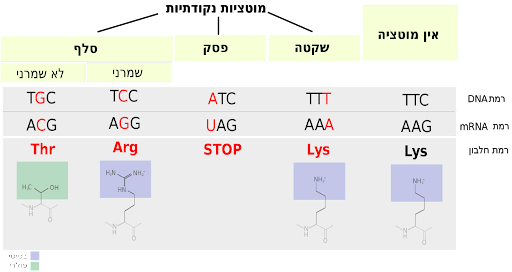
מוטציות נקודתיות
מוטציה נקודתית (בעברית: תשנית נקודתית) או החלפה היא מוטציה גנטית, שבה נוקליאוטיד בודד מוחלף, מתווסף או מוסר מרצף DNA או RNA בגנום של אורגניזם. למוטציות נקודתיות יכולות להיות השפעות שונות על התוצר החלבוני, ולעיתים ניתן לחזות השלכות של מוטציות ספציפיות. ייתכן שלהחלפה לא תהיה השפעה כלל על התוצר החלבוני, והדבר מכונה החלפה נרדפת, אך ייתכנו השלכות עם פוטנציאל הרסני, כגון מוטציית פסק ומוטציית סלף. מוטציות נקודתיות הן הסוג הדומיננטי של SNP בגנום.
גורמים: מקורן של המוטציות הנקודתיות הוא לרוב בתהליך שכפול ה-DNA. שכפול קורה כאשר DNA דו-גדילי נפרד לשני גדילים, שכל אחד מהם משמש תבנית ליצירת גדיל משלים, ולפיכך הכנסה של מוטציה נקודתית תשוכפל הלאה. ההכנסה יכולה לקרות בצורה ספונטנית. קצב יצירת המוטציות עולה עקב חשיפה למוטגנים. מוטגנים יכולים להיות פיזיקליים, כגון קרינת UV, קרני X, חשיפה לחום קיצוני או כימיקלים אשר פוגעים בשלמות ה-DNA. מנגנונים שונים מובילים ליצירת מוטציה נקודתית.
קרינת UV מסוגלת ליינן אלקטרונים, ובכך להשפיע על הבסיסים המרכיבים את ה-DNA או ה-RNA. מולקולות חמצן פעילות בעלות רדיקלים חופשיים (ROS), שהן תוצר לוואי של מטבוליזם תאי, עלולות אף הן להזיק ל-DNA. תוצרי היינון והרדיקלים החופשיים יכולים לגרום לשבר חד- או דו- גדילי. שלמות ה-DNA יכולה להיפגע כתוצאה מהרס של הקשרים הכימיים בין המולקולות שמרכיבות אותו. בנוסף, טעויות של אנזימים המשתתפים בתהליך יכולות להוביל להחלפה, החסרה או הכנסה של מוטציות.
מוטציה שתוביל לשינוי באזור המקודד וברצף חומצות האמינו של חלבון, יכולה להביא לשינוי בפעילות החלבון, במבנהו התלת-ממדי, במיקומו, ביציבותו ובאפשרותו ליצור קשרים עם חלבונים אחרים. שיטות רבות מנסות לחזות את ההשלכות של מוטציות כאלו על חלבונים. חוקרים נעזרים באלגוריתמים של למידת מכונה, שבהם המכונה מקבלת רשימה של מוטציות ידועות שאין להן השלכה רפואית ומוטציות אשר מובילות למצבים רפואיים שונים.
מודלים שונים משלבים רמות נוספות של ידע, כגון רמת השמירות האבולציונית של הנקודה הספציפית בגנום של יצורים שונים. כאשר המוטציה הנקודתית נמצאת באתר הפעיל של אנזים, קולטן או חלבון נשא – נושא המוטציה יתפקד בצורה שונה מהנורמלי.
Single nucleotide polymorphism [SNP]
רב-צורניות של נוקלאוטיד בודד, (מכונה גם "סניפּ") הוא וריאציה של רצף הדנ"א המתרחשת כאשר נוקלאוטיד יחיד A,T,C,G בגנום נבדל בין פרטים במינים ביולוגים או בין כרומוזומים הומולוגיים באדם. למשל, עבור שני מקטעי דנ"א בשני פרטים שונים, AAGCCTA מול AAGCTTA, מכיל שינוי בנוקלאוטיד יחיד, כלומר SNP. במקרה זה נאמר כי קיימים שני אללים. כמעט לכל הסניפּים הנפוצים יש שני אללים בלבד. ההתפלגות הגנומית של הסניפּ אינה הומוגנית. בדרך כלל סניפּים מופיעים באזורים לא מקודדים בתדירות גבוהה יותר מאשר באזורים המקודדים, באופן כללי, באזורים מקודדים שינויים אלו יעברו סלקציה חזקה יותר ויתקבעו פחות בדנ"א. פקטורים נוספים כגון רקומבינציה גנטית יכולים גם כן להשפיע על תדירות הסניפּים. ניתן לנבא את תדירות הסניפּים באמצעות נוכחות מיקרוסטלייטים (Microsatellite, רצפים חוזרים קצרים) במיוחד באמצעות רצפי AT.
חזרות רבות של AT יכולות לנבא תדירות נמוכה של סניפּים.שונות בין אוכלוסיות האנשים בעולם נגרמת בין היתר על ידי סניפּים. סניפּים אלו יכולים להיות נפוצים באזור גאוגרפי מסוים או בקבוצות אתניות מסוימות ונדירים באוכלוסיות אחרות. שינויים גנטיים אלו בין פרטים (במיוחד באזורים לא מקודדים בגנום) מנוצלים לצורך טביעת-אצבע של דנ"א (DNA fingerprinting) בביצוע זיהוי פלילי.
בנוסף, שינויים גנטיים אלו יכולים להוות בסיס לשוני ברגישות למחלות. חומרת המחלה והדרך בה הגוף מגיב לטיפולים מעידים על שוני גנטי. לדוגמה, סניפּ בגן APOE עשוי להעיד על סבירות גבוהה יותר למחלת האלצהיימר. סניפים יכולים להתרחש באזורים מקודדים בגנום, באזורים לא מקודדים, ובאזורים בין גנים. סניפים ברצפים מקודדים לא בהכרח ישנו את רצף חומצת האמינו בחלבון שנוצר מכיוון שקיימים מספר רצפים שיוצרים את אותה חומצת האמינו.
ניתן לחלק את הסניפים באזורים המקודדים לשני סוגים לפי סוג המוטציה שהם יוצרים: סניפים היוצרים מוטציות שקטות (synonymous) וכאלו שיוצרים מוטציות לא שקטות (nonsynonymous). סניפים שיוצרים מוטציות שקטות לא ישפיעו על רצף החלבון, בעוד שהסניפים הלא שקטים ישנו את חומצת האמינו בחלבון. סניפים לא שקטים נחלקים גם הם לשני סוגים: missense ו- nonsense.
סניפים באזורים לא מקודדים יכולים עדיין להשפיע על שחבור (splicing) של גנים, חיבור של פקטורי תרגום (transcription factor), פרוק רנ"א שליח (mRNA) והשפעה על אזורי רנ"א לא מקודדים. סניפים אלו הפוגעים בביטוי נקראים eSNP ויכולים להיות upstream או downstream לגן.
סניפים, שינויים ברצפי DNA באדם, יכולים להשפיע על האופן של האדם לפתח מחלות ולהגיב לפתוגנים, כימיקלים, תרופות, חיסונים וסיכונים אחרים. בנוסף, לסניפים חשיבות ברפואה המותאמת אישית. עם זאת, חשיבותם העיקרית במחקר הביו-רפואי היא לצורך השוואת אזורים גנומים בין קבוצות (למשל בין חולים ובריאים) ושימוש בנתונים אלו עבור Genome-wide association study [GWAS]. לסניפים בדרך כלל יש שני אללים ולכן אפשר לעשות עליהם בדיקות מעבדה בקלות. סניפ אחד יכול לגרום למחלה שמועברת בתורשה מנדלית. עבור מחלות מורכבות בדרך כלל המחלה נובעת כתוצאה מצירוף בין כמה סניפים, למשל כמו אוסטיאופורוזיס. ב-26 ביוני 2012, dbSNP רשמו 53,558,214 סניפים באדם.
סניפים יכולים לשמש כמרקרים במיפוי גנטי. הידע על הסניפים עוזר בהבנת פרמקוקינטיקה (השפעת הגוף על התרופות) ופרמוקודינמיקה (השפעת התרופות על הגוף). מגוון רחב של מחלות בבני אדם, כגון סרטן, מחלות זיהומיות (איידס, צרעת, צהבת וכדומה), אנמיה אוטואימונית, אנמיה חרמשית, תלסמיה β וסיסטיק פיברוזיס עלולות להיגרם כתוצאה מסניפים. בנוסף, סניפים יכולים להשפיע על מטבוליזם של תרופות שונות.
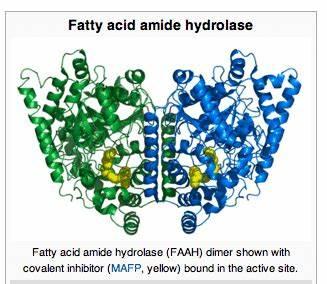
במהלך השנה האחרונה התמקדתי באפיון חלבוני מטרה (קולטנים, חלבונים נשאים, אנזימים וגורמי שעתוק) אשר מעורבים בתגובה האישית לקנבינואידים שונים – ובעיקר THC ו-CBD. אפשר למצוא סניפים אצל חולים בהפרעות נפשיות שונות כשסעת {סכיזופרניה}, הפרעה דו-קוטבית, הפרעת קשב וריכוז וגם חרדות, דכאון קליני ונטייה אובדנית. בכפרי-איזון ובמחלקות פסיכיאטריות ניתן לקבל רמזים להמצאות הרבה סניפים בבדיקת רוק של מטופלים שנפגעו מ-THC ו/או ממשני-תודעה שונים וסבלו מ"טריפ רע".
נושא חשוב נוסף הוא לאפיין מראש מי יגיב טוב לקנבידיאול, מי לא יגיב בכלל ומי עלול להינזק. מתברר שהחלבון החשוב ביותר בהקשר זה הוא האנזים FAAH אשר מפרק חומצות שומן וביניהן אננדמיד. קנבידיאול הוא מעכב FAAH טבעי.
לשם בדיקת נוכחות האנזים הזה (למשל ע"פ קרומיות של טסיות הדם) משתמשים בסובסטרט = אננדמיד מסומן בחומר רדיואקטיבי ומזהים את התוצר – אתנולאמין. גם שיטות LIQUID CHROMATOGRAPHY MASS SPECTROMETRY מתאימות לזיהוי האנזים הזה.
הסיפור של גב' ג'ו קמרון מסקוטלנד
הגברת מסקוטלנד שנבדקה בשנת 2019 היא בעלת פנוטיפ ייחודי המתבטא בחסר פעילות של האנזים FAAH. כתוצאה מכך בדמה רמות גבוהות של אננדמיד, היא לא חשה פחד או כאב, היא שמחה ואופטימית, נפצעת ונכווה פעמים רבות וגם מתרפאת מהר מאד מהפציעות. אחרי מספר שנות מחקר זוהה אצלה גן חדש שכונה: FAAH-OUT. הגן הזה נמצא ב- JUNK DNA שסברו בעבר שהוא חסר תפקוד. המוטציה אצל האישה הזאת גרמה לחסימת ההתבטאות של הגן התקין שמקדד ל-FAAH. בגנום שלה נמצאו עוד 797 גנים שהתבטאותם הוגברה ו- 348 גנים שכובו.
לאחרונה התברר שאנשים שאצלם האנזים FAAH לא פעיל, מאופיינים בשמחת-חיים ואופטימיות בהשוואה לאלו שאצלם האנזים פעיל מאד. נראה שאצל אנשים שאצלם האנזים הזה פעיל מידי, יופיע דיכאון קליני.
מלבד סניפים בגנים שמקדדים ל-FAAH, אפיינתי סניפים בגנים אשר מקדדים ל-CB1 ול- CB2. גם החלבון שמעביר אננדמיד מהחלל סינפטי לתוך התאים, גורמי שעתוק וגם אנזימי CYP450 בכבד שמבצעים מטבוליזם של פיטוקנבינואידים. הצעת המחקר מה- 30/5/22 ממתינה לתקציב בכדי לקחת את הטבלה המצורפת להלן ולזהות את הסניפים בדגימת DNA מרוק בשיטות ביולוגיה מולקולרית כ- PCR או CRISPR.
חלבוני המטרה:FAAH, CB1R, MOR, DRD2, FABP-5&7, DAT1, 5-HTTLPR, COMT, AKT1 & CHRNA2
סה"כ אפיינתי תריסר חלבוני מטרה ע"פ השפעות פסיכיאטריות ייחודיות
Reference SNP = rs#
בדיקת לימפוציטים מדגימת דם
לימפוציט מסוג B הוא סוג של תא דם לבן. תאי-B אחראים ליצירת נוגדנים (תגובה הומורלית). הם נוצרים במח העצם ועם הבשלתם מגיחים למערכת הלימפה, דרכה הם מגיעים לחלקי הגוף השונים. מקור השם לימפוציט "B" הוא בלוטת הבורסה הקיימת בעופות, שם התגלו התאים הללו לראשונה.
סיווג:
תאי קדם B: בתאי העצב מבשילים תאי B על ידי תהליך של סידור מחדש של הגנום שלהם, היוצר בכל תא B אזור שונה המקודד לנוגדן עם ספציפיות לאנטיגן שונה. התא עובר ביקורת, על מנת לוודא כי הנוגדנים שלו אינם נקשרים לחומרים עצמיים לגוף, ורק אז מקבל "אישור" להמשיך בהתמיינותו. במקרה בו התא אכן מכיל נוגדנים הקושרים אנטיגנים עצמיים, התא עשוי לקבל "הזדמנות נוספת" לסידור אחר באמצעות כרומוזומים הומולוגיים או מקטעים שונים המקודדים לנוגדן שעדיין נותרו בו (כגון שרשרת "למדא" בתת-היחידה הקלה).
תאי B בוגרים: תאי B אלו, הנמצאים בעיקר במערכת ההובלה, מבטאים על-גבי ממברנת התא שלהם קולטנים הקרויים BCR (ראשי תיבות באנגלית: B Cell Receptor). בתגובה למפגש עם אנטיגן מתמיינים תאים אלו לתאי B מופעלים.
תא B מופעל: תא B שבא במגע עם אנטיגן חופשי או שהוצג לו אנטיגן על ידי קומפלקס MHC מסוג II ושגורה על ידי ציטוקין מתאים. בעקבות המגע עם האנטיגן תא ה-B הופך למופעל ומנסה ליצור נוגדנים חדשים. אם תא ה-B המופעל יצליח ליצור נוגדנים יעילים שאינם מכוונים כנגד אפיטופ עצמי, הוא יתחלק ויתמיין לתאי פלזמה ולתאי זיכרון. אם תא ה-B המופעל ייכשל בייצור נוגדן יעיל, התא ימות בתהליך של מוות תאי מבוקר – אפופטוזה.
תא שהצליח ביצירת נוגדנים מתחלק ומקים "שבט" – clone של תאי B בעלי גנום זהה, המייצרים אותם נוגדנים. לעיתים מתבצעת החלפת סוג הנוגדן- class switching (רק ב Fc של הנוגדן, ללא שינוי האנטיגן) ותא הבת מייצר ומפריש נוגדנים ממחלקה שונה, אך שנצמדים לאותו האנטיגן.
תא פלזמה: תא המפריש כמות גדולה של נוגדנים שאינו מתחלק.
תאי זיכרון: תאים בעלי ספציפיות גבוהה לאנטיגן מסוים. נוצרים בתגובה כנגד אנטיגן. מסוגלים לחיות זמן רב בגוף, עם חשיפה לאנטיגן יכולים תאים אלו להתחלק ולהתמיין לתאי פלזמה מפרישי נוגדנים.
תאי B מבטאים סמנים שונים במהלך התפתחותם, וכך, מסייעים באבחון הסוגים שונים של לימפומות ולוקמיות. הסמנים אותם מבטאים תאי B הם: CD10, CD19, CD20, CD21, CD22, CD5, CD38 וכן HLA-DR.
על-פני קרומיות תאי B נמצא ריכוז גבוה של קולטני CB2. לאחרונה התברר שהקולטנים הללו מפקחים על התגובה החיסונית לגידול ממאיר במחלת המלנומה (סרטן עור). החולים שבתאי B שלהם היו הרבה מאד קולטני CB2, שרדו בחיים הרבה יותר זמן. יתר-על-כן, בעכברים חסרי תאי B שעליהם הרבה קולטני CB2 – המלנומה המושרית התפתח מהר יותר.
הקולטן CB2 מפקח על התפתחות לימפוציטים ועל התגובה הדלקתית שהם מפתחים באמצעות שחרור ציטוקינים שהם גורמים מסיסים במים אשר משוחררים מתא חיסוני אחד ומשפיעים על תאים חיסוניים אחרים. אגוניסטים סינטטיים סלקטיביים רק ל- CB2 נבדקים כרגע כתרופה למחלה הממארת הזאת. בכדי להעריך את רמת הפעילות הכללית של ה-ECS ולקבוע האם אדם מפתח חסר פעילות של ה-ECS, אפשר לכמת את התבטאות קולטני CB2 על-פני לימפוציטים מטיפוס B בשיטות המטולוגיות מקובלות.
בדיקת טסיות PLATELETES מדגימת דם
על-פני הקרומיות של טסיות הדם, נמצא האנזים FAAH ולכן חשוב לבדוק את הריכוז שלו בכדי לקבוע אם אדם לוקה בחסר פעילות של המערכת האנדוקנבינואידית. פעילות-יתר של האנזים הזה תגרום לפירוק מואץ של אננדמיד במחזור הדם ועלולה להתפתח ירידה בתפקוד ה-ECS. את הטסיות אפשר להפריד בקלות מדגימת דם ולבדוק בשיטות שונות את נוכחות האנזים FAAH כמדד בדם להמצאות חסר פעילות של ה-ECS.
בדיקת פעילות חשמלית (גלי מוח)
EEG הוא קיצור של אלקטרואנצפלוגרם (Electroencephalogram).
בבדיקת EEG מודדים את הפעילות החשמלית במוח באמצעות אלקטרודות אשר מונחות על הקרקפת. הפעילות החשמלית המוחית מתועדת בתרשים של גלי מוח. יש כמה מצבים שעלולים להשפיע על הפעילות החשמלית התקינה של המוח ועל הדפוסים של גלי המוח שנרשמים בבדיקת ה־EEG. גרף ה־EEG שנפלט ממכשיר הבדיקה מחולק לשורות. כל שורה מייצגת מונטאז' כלשהו לפי בחירה. ישנם מספר סוגי מונטאז':
מונטאז' דו־קוטבי – מתאר את המידע המתקבל בין 2 אלקטרודות סמוכות.
מונטאז' ייחוסי (referential) – מתאר את המידע המתקבל בין אלקטרודות באופן ייחוסי. למשל, אלקטרודה הנמצאת בצד הפרונטלי השמאלי, הנמדדת באופן יחסי לאלקטרודה במרכז הקרקפת. מונטאז' מסוג זה מחולק למספר תתי־סוגים, שכן ניתן להעמיד כל אלקטרודה במעמד המייחס. הגרף מחולק לאזורי מדידה לפי הנחת האלקטרודות והמונטאז'.
קריאת הגרף המתקבל תלויה בכיוון הראש, בדרך כלל הגרף מתייחס לראש הפונה ימינה. כלומר, שורות 1–4, הראשונות, תתייחסנה לאזור השמאלי החיצוני של הראש. 4 השורות הבאות תתייחסנה לקו השמאלי בין הקו החיצוני לקו המרכזי. 2 שורות בלבד תתייחסנה לקו המרכזי בשל נוכחות 3 אלקטרודות, וכך הלאה עד ל־4 השורות האחרונות המתייחסות לקו הימני החיצוני. השורה הראשונה בכל קבוצה מתייחסת לאזור הפרונטלי של הראש ואילו השורה האחרונה מתייחסת לאזור הפוסטריורי (האחורי) של הראש. לקריאה נוחה של הגרף ניתן להגדיר רגישות למגבר. הרגישות המקובלת היא 7.5 מיקרו־וולט. ככל שהמתח חשמלי נמוך יותר, כך הרגישות גבוהה יותר, כלומר, ניתן לראות את הגלים יותר בבירור.
את הגלים המתחלקים ניתן למדוד בעזרת הגדרות הלקוחות מעולם הפיזיקה:
תדירות – מספר הגלים לשנייה (מספר המחזורים ליחידת זמן). נמדדת בהרץ (Hz).
אורך גל – המרחק שאותו מתקדם הגל במחזור אחד. נמדד במילי־שניות או בשניות.
משרעת – ההפרש בין גובה השיא של הגל לבין הנקודה הנמוכה ביותר. גובה המשרעת הוא עד 200 מילי־וולט.
בעזרת ההגדרות הללו ניתן לסווג ולאפיין את סוגי הגלים:
גלים בעלי תדירות רגילה – מונח המתאר את גלי ה־EEG הנעים בזה אחר זה במשך זמן קבוע. הגלים לא צריכים להיות זהים אחד לשני אלא דומים.
א־ריתמית – גלי EEG הנעים בתדירות לא סדירה. כלומר, משך הגל אינו קבוע.
דיס־ריתמית – גלי EEG, או מגמות בגלים, שמופיעים בקבוצות אוכלוסייה כמו אנשים החולים במחלה מסוימת, ובהם בלבד.
פענוח גלי ה־EEG מושג באמצעות ניתוח תדירויות הגלים והבנת המעברים ביניהם, זאת באמצעות המושגים הבאים:
תדירות הגלים, ארגון הפעילות – סיווג לפעילות בהמיספירה ימין או בהמיספירה שמאל, בחלק האנטריורי או בחלק הפוסטריורי של הקרקפת; א־סימטריה וסינכרון אינטר־המיספרי.
מצב הנבדק – שינה או ערות, לחץ או רוגע וכיוצא בזה.
ה־EEG התקין בכל הגילאים הוא בדרך כלל סימטרי, שאינו מסונכרן בין שתי ההמיספרות, אך תדירות הגלים ודפוסי הגלים הנוספים תלויים בגיל הנבדק.
חלוקת מבנה הגלים:
Spike – גל חד שמשכו 25–70 מילי־שניות.
Sharp Wave – גל חד שמשכו 70–200 מילי־שניות.
Slow Wave – גלי תטא או דלתא מאד איטיים.
Sharply Contoured Slow Wave – גל חד שמשכו מעל 200 מילי־שניות.
Epileptiform Discharge – גלים מחזוריים אשר חורגים בצורה ניכרת מהתבנית ומעלים חשד לנוכחות התקפים אפילפטיים.
טווח הגלים הנפוץ ביותר שנצפה ב־EEG בקורטקס נמצא בטווח של 1–20 הרץ (פעילות מתחת לטווח זה תהיה ככל הנראה מלאכותית). הגלים מחולקים על פי צורתם לרוחבי פס שונים, המכונים: אלפא, בטא, גמא, תטא ודלתא. כל אחד מטווחי גלים אלו מייצג מצב אחר של ערנות ופעילות ומופיע במיקום שונה במוח.
גלי דלתא – הם גלים שתדירותם היא עד 4 Hz. גלים אלו הם בעלי המשרעת הגדולה ביותר והם גם הגלים האיטיים ביותר. הם מופיעים בדרך כלל במוח הקדמי אצל מבוגרים ובמוח האחורי אצל ילדים. באופן נורמלי, הם מופיעים במבוגרים בשינה עמוקה, ואצל תינוקות. לפעמים נראים גם בפעילויות שדורשות תשומת לב מתמשכת. באופן פתלוגי, הם מופיעים בעת פגיעות סאב־קורטיקליות, פגיעות דיפוזיות או פגיעות בקו האמצע של המוח; במחלות מוח מטבוליות, בהידרוצפלוס (מיימת המוח) ובמצב של תרדמת (comma).
גלי תטא – הם גלים בטווח התדרים 4–7.9 Hz. באופן נורמלי טווח זה מופיע בעיקר בנמנום אצל ילדים. הוא עשוי גם להופיע בנמנום או בזמן ההתעוררות אצל מבוגרים. גלים אלו קשורים לעיכוב של תגובות מעוררות (מצאו כי טווח זה מופיע באופן בולט במצבים בהם אדם מנסה באופן פעיל להדחיק תגובה או פעולה). בנוסף, טווח זה נקשר לדיווחים על מצבים רגועים, מדיטטיביים ויצירתיים. עודף בהימצאות טווח זה במוח האחורי מתרחש אצל מבוגרים ערניים, או שהוא מופיע בצורה מוקדית. באופן פתולוגי, הוא מופיע בעיקר באנצפלופתיה אצל ילדים. הוא מופיע בעת פגיעות סאב־קורטיקליות, פגיעות דיפוזיות או פגיעות בקו האמצע של המוח; ובמקרים מסוימים של הידרוצפלוס.
גלי אלפא – הם גלים בטווח התדרים 7–13 Hz. אלו הגלים הראשונים בהם צפה הנס ברגר ממציא ה-EEG ולכן קרא להם "גלי אלפא". גלים אלו מופיעים באזורים האחוריים של הראש בשני צדדיו, במשרעת גבוהה יותר בצד הדומיננטי. במנוחה הם נצפים באזורים המרכזיים (c3-c4). באופן נורמלי, טווח זה מופיע בסגירת העיניים ובהרפיה, ומתמעט עם פתיחת העיניים או בעת מאמץ נפשי. התדירות הבסיסית בחלק האחורי נמוכה יותר מ־8 Hz אצל ילדים קטנים (לכן טכנית הגלים האלו נמצאים בתחום גלי התטא). בעת מצב COMA (תרדמת), ניתן לראות EEG של גלי אלפא בעלי מופע אקראי.
גלי בטא – הם גלים בטווח התדרים 13–30 Hz. הם מופיעים בדרך כלל משני צִדי המוח בצורה סימטרית, בעיקר בחלקו הקדמי. גלים אלו הם בעלי משרעת נמוכה. לגלים אלו יש קשר ישיר לפעילות המוחית הקשורה ללמידה וליכולת הקוגניטיבית של המוח ברגע נתון. גלי בטא מייצגים עוררות, קשב ולעיתים אפילו חרדה (במיוחד בקצה העליון של התדירויות). טווח התדרים של גלי הבטא גדול ולכן הוא מחולק בדרך כלל לשני חלקים: בטא נמוך ובטא גבוה. כשהמוח נמצא בתדר בטא (תדר גבוה יחסית), הדבר מייצג רמת סנכרון נמוכה של רשתות המוח, כלומר, זהו מצב בו המוח נמצא ברמת אנרגיה גבוהה וצורך הרבה משאבים מטבוליים. באופן פתלוגי, טווח זה מופיע בעת שימוש בבנזודיאזפינים. במחקר עדכני נמצא כי בתגובה לקול, גלי אלפא-בטא משתנים בין ערות לשינה. החוקרים מייחסים זאת לתהליכים של קשב וציפייה.
גלי גמא – הם גלים בטווח התדרים 30–100 Hz. גלים אלו מופיעים בקליפת המוח הסומטוסנסורית (somatosensory cortex). טווח זה קשור לפעילות מוחית רשתית בקנה מידה גדול, ופעילות קוגניטיבית כמו זיכרון פעיל, תשומת לב וקיבוץ של תפיסות שונות. גלי גמא קשורים גם להפעלת מערכת העצבים הסימפתית. טווח זה נקשר להפרעות מצב רוח שונות, כגון אפילפסיה, אלצהיימר וסכיזופרניה.
במצבים אפילפטים (מחלת הנפילה) מבחינים בשני אירועים:
Ictal events שהם השלב האמצעי של העוויתות שבו פעילות המוח בלתי צפויה.
Interictal events הם אירועים קצרים (פחות מ-250 מילישנייה) שנגרמים עקב עוויתות ספונטנית שמקורן באתרים אפילפטיים שונים במוח.
השפעת קנביס על חולי אפילפסיה
לאחרונה התברר ששימוש בקנביס אצל חולי אפילפסיה גורם לירידה בחומרת האירועים האינטריקטלים ולא השפיע כמעט על האירועים האיקטלים. חולי אפילפסיה רבים משתמשים בקנביס בעישון או באכילה בכדי לשכך את חומרת ההתקפים האפילפטיים.
אפשר לעשות שימוש במדידות EEG מרובות כדי לייצר אלגוריתם אשר יאפיין את גלי המוח של הלוקים בחסר פעילות של ה-ECS.
שינויים בגלי המוח בהשפעת קנביס
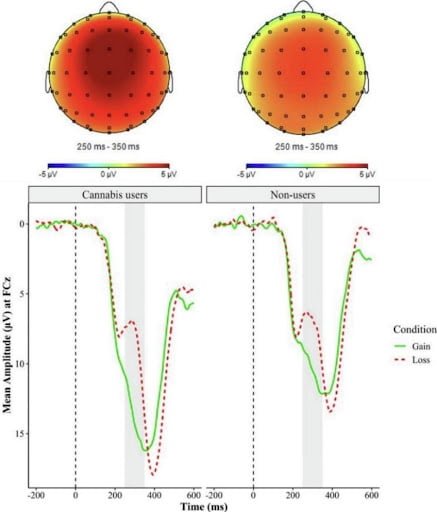
במחקרים מוקדמים נמצא שה-THC גורם לעלייה בכמות גלי האלפא ולירידה בכמות גלי הבטא במוח. לאחרונה התברר ששימוש כרוני בקנביס מוריד את גלי התטא. כאשר בדקו משתמשים בקנביס בסימולטור נהיגה בזמן שהם שומרים על נתיב נהיגה ביחד עם בדיקת EEG, הבחינו בעליה בקצב הלב במקביל לירידה בגלי התטא. אצל המשתמשים בקנביס לראשונה נמצאה פעילות עצבית מוגברת בתגובה לגמול חיובי (הענקת כסף). אצל משתמשים כרוניים השפעת הקנביס על התגובה לגמול חיובי הייתה נמוכה יותר.
עקב גמילה פתאומית מ-THC של משתמשי קנביס כרוניים, עולים בצורה חדה גלי האלפא באונה הקדמית של המוח. תמונת גלי המוח אצל הנגמלים מקנביס בפתאומיות דומה מעט למצב אפילפטי ובמקביל מופיעה מיגרנה חמורה. מדידת גלי האלפא, בטא, דלתא וגמא בסובלים מאי-תפקוד של ה-ECS תחקר ביסודיות בכדי לזהות את ההפרעה בעזרת בדיקה לא פולשנית ע"י EEG.
מתחילת המחקר במדידות EEG של מעשני קנביס בתחילת שנות השבעים, התברר שכעשר דקות אחרי תחילת העישון חלה עלייה בעוצמת גלי האלפא וירידה בתדירות שלהם באונה הקדמית של קליפת המוח, במקביל להתפתחות הרגשת התרוממות הרוח = HIGH)). עישון הקנביס גרם לירידה בעוצמת גלי הבטא וניכרו גם שינויים בסינכרוניזציה של גלי התטא. בדומה לשינויים הללו ב- EEG, עלה גם קצב הלב שהגיע לשיאו כחמישים דקות לאחר תחילת עישון הקנביס.
מבדיקת תמונת ה-EEG וקצב הלב של מטופלים חדשים וותיקים בתגובה לקנבינואידים שונים אפשר לבנות אלגוריתם מתמטי שיחזה את תוצאות הטיפול באופן אישי. בצורה שכזאת נוכל לתת כלי מדידה אובייקטיבי ומדויק לכל מטופל ללא צורך בהסתמכות על עדויות של מטופלים אחרים, רוקחים ו/או מגדלים. רפואה מותאמת אישית. לימוד תמונת גלי המוח בקליפת המוח ושיטות הדמיה נוספות כמגנטו-אנצפלוגרפיה [[MEG תעזורנה לחקור מצבים פתולוגים כאפילפסיה, אוטיזם, טורט, פיברומיאלגיה, פרקינסון, אלצהיימר, MS, PTSD ושיטיון [דמנציה].
מטופלים חולי אפילפסיה חלוקים בנושא הקנבינואיד שמועיל להם ביותר ומונע התקפים: יש אומרים – THC ויש אומרים – CBD ולפיכך, ייעשה מאמץ לפתור את התעלומה בעזרת מדידות גלי המוח. מעניין לציין שתמונת ה-EEG של חולי פיברומיאלגיה מצביעה על אבנורמליות בגלי הדלתא וקנבינואידים מצליחים לתקן את ההפרעה. נשווה את תמונת גלי המוח בהשפעת הקנביס למתרחש אצל מתרגלי מדטציה טרנסדנטלית מיומנים, שבמוחם נמצאה קוהרנטיות גבוהה בין גלי המוח השונים [אלפא, בטא, דלתא ותטא] שמשמעה הוא שחלקי המוח השונים פועלים ביחד! כשלמות אחת. זאת תמונת גלי המוח שאליה נשאף להגיע בהשפעת הקנביס המותאם אישית.
fMRI
הדמיה של המוח על-ידי תהודה מגנטית (Magnetic Resonance Imaging – MRI) היא שיטה העושה שימוש בגלי רדיו ובמגנט בעל עוצמה רבה, בכדי להפיק תמונות מפורטות של המוח. הדמיה תפקודית של המוח בתהודה מגנטית (Functional MRI – fMRI), היא שיטה המאפשרת, בנוסף למיפוי המבני שמתקבל על-ידי ה-MRI, מיפוי של תפקודי המוח בזמן אמת. הבדיקה התפקודית מבוססת על זיהוי שינוי באות מגנטי מרקמת המוח המתרחש בעקבות שינוי בזרימת דם מחומצן לאזורים בהם תאי המוח הופעלו.
באמצעות שיטת ה-fMRI, ניתן להפיק תמונה תפקודית ברזולוציה מרחבית גבוהה של כלל המוח. יתרונה הבולט על פני שיטות מיפוי תפקודי אחרות, הוא היותה שיטה לא פולשנית, אשר אינה מבוססת על קרינה מייננת (כמו רנטגן או CT) ואינה מחייבת הזרקת חומר ניגוד או חומר רדיואקטיבי כלשהו. אי לכך, הבדיקה אינה מסוכנת וניתן לחזור עליה מספר פעמים לפי הצורך. בדיקת CT) ) Computerized Tomography היא בדיקת דימות המבוצעת באמצעות מכשיר המנצל את אפקט קרני הרנטגן החודרות באופן שונה דרך רקמות שונות בגוף.
PET SCAN
טומוגרפיית פליטת פוזיטרונים (Positron Emission Tomography, ובראשי תיבות: PET) היא טכנולוגיית דימות רפואי ברפואה גרעינית המבוססת על פליטת פוזיטרונים. לצורך הדמיית PET מזריקים לגוף מולקולות אשר משתתפות בפעילויות ביולוגיות בגוף שבהן החליפו את אחד האטומים באיזוטופ רדיואקטיבי המתפרק בהתפרקות בטא פלוס ופולט פוזיטרון.
בשל רדיואקטיביות זו פולטים החומרים פוזיטרונים בעודם בגוף האדם. מיד לאחר פליטתם מתנגשים הפוזיטרונים באלקטרונים והזוג מתאיין תוך כדי פליטת שני פוטונים של קרינת גמא בכיוונים כמעט מנוגדים. המתקן שבתוכו מצוי הנבדק רגיש לקרני גמא כפולות, וחיישניו מחוברים למחשב, המעבד את המידע ויודע לזהות על פיו את האזור שבו נפלטו הקרניים.
החומר הנפוץ ביותר בבדיקות PET הוא פלואורו-דאוקסי-גלוקוז (fluorodeoxyglucose, או בראשי תיבות: FDG), שהוא אנלוג של מולקולת גלוקוז שבו אחת מקבוצות ההידרוקסיל הוחלפה באיזוטופ הרדיואקטיבי פלואור-18. ההנחה היא שאזורים פעילים בגוף, ובמיוחד גידולים סרטניים, צורכים כמויות גדולות של גלוקוז ובשל כך צפויות להתרחש בסביבתם פליטות גמא רבות.
האומדן שמספק ה-PET לגבי מיקומם וזמנם של תהליכים פיזיים ומנטליים נחשב לגס יחסית, אם כי יש לו יתרון על פני CT או MRI בזיהוי בלוטות לימפה עם גרורות, בעיקר אם בלוטות אלו קטנות מ-1 ס"מ (עובי חתך נפוץ). האיזוטופים בהם משתמשים ב-PET הם בעלי זמן חיים קצר יחסית, למשל לפלואור-18 זמן מחצית חיים של 110 דקות ואיזוטופים אחרים בשימוש הם בעלי זמן מחצית חיים אף קצר יותר. לכן יש להכין את החומרים המוזרקים בקרבת המכשיר, לרוב על ידי ציקלוטרון.
לאחרונה משלבים בדיקת CT עם טומוגרפיה ממוחשבת – לבדיקת PET-CT שהיא מדויקת יותר. לשם קביעת ריכוז הקולטנים האנדוקנבינואידים משתמשים באגוניסט ייחודי בזיקה גבוהה לקולטן CB1 אשר מסומן רדיואקטיבית = C]OMAR11].
OMAR = הוא קנבינואיד סינטטי של האוניברסיטה העברית HU75528 אשר נקשר בזיקה גבוהה לקולטנים CB1. בעזרת הבדיקה הזאת התברר שאצל משתמשי קנביס כרוניים חלה ירידה בצפיפות הקולטנים הללו בחלקי מוח שונים: היפוקמפוס, אמיגדלה, סינגולט גירוס והאינסולה. לשם קביעת פעילות האנזים FAAH משתמשים בחומר המוצא – CURB[11C] = RADIOTRACER מסומן בפחמן רדיואקטיבי ובודקים את הופעת התוצר – אתנולאמין מסומן.
URB597 הוא אנטגוניט (מעכב) ייחודי בלתי הפיך אשר קושר בזיקה גבוהה את האנזים FAAH שמבוטא בריכוז גבוה בקורטקס הקידמי.
בביה"ח איכילוב בת"א נמצאת מעבדת נוירומודולציה משוכללת למחקר המוח. הטיפולים במעבדה הזאת מבוססים על העצמת פעילות המוח בעזרת גרייה של אזורי מוח שונים ובשיטות שונות (גרייה חשמלית, גרייה מגנטית וגריה עצמונית בעזרת ממשק מוח מכונה). הטיפולים במרפאה מותאמים באופן אישי עבור כל מטופל, ונעשים בשיטות לא פולשניות וללא שימוש בתרופות. כל מטופל המגיע למרפאה עובר הערכה טרום טיפולית קפדנית על ידי רופא מומחה ופסיכולוג (או נוירו-פסיכולוג), על פיה נקבעת לו תכנית טיפול ייעודית אישית. מטרת הטיפולים המוצעים במרפאה היא השרייה של שינוי בפעילות המוחית, אשר עשויה להביא לשיפור קליני. השינוי המושרה מכוון לאזור המוחי הרלוונטי להפרעה הכרונית ממנה האדם סובל.
סיכום ומסקנות
למרות שפרויקט הקנביס הרפואי בישראל צמח בצורה מהירה מאז 2011, הידע בתחום עדיין לוקה בחסר והיעוץ הרוקחי בבתי המרקחת מתרכז ב"אינדיקה ללילה וסאטיבה ליום" למרות שהוכח לאחרונה שההבדל היחיד בין שני ה"זנים" הוא מציאות של קצת יותר טרפן מרגיע בשם מירצן [MYRCEN] ב"אינדיקה". מתברר שכרגע כל הקנביס הרפואי הוא היברידי ולכן החלוקה האנכרוניסטית הזאת היא חסרת ערך – מלבד ערך שיווקי לחוות וליבואני התפרחות לשימוש רפואי.
ה"ספר הירוק" של היק"ר והטבלאות של ריכוזי ה-THC וה-CBD כטיפול במחלות והפרעות שונות, הם מוטעים מהיסוד ולא מקובלים בשום מקום אחר בעולם. גם הקביעה השרירותית של הגבלת ריכוזי הפיטוקנבינואידים היא חסרת בסיס מדעי וגורמת לעישון של הרבה חומר צמחי מזיק כאשר ריכוזי ה-T וה-C בתפרחות נמוכים מאד. חוסר תפקוד של ה-ECS באדם יכול לנבוע משלושה גורמים שונים:
- מיעוט קולטנים אנדוקנבינואידים או פגיעה בהפעלה שלהם.
- ירידה בייצור האנדוקנבינואידים מחומרי המוצא בקרומיות התאים בשל ירידה בפעילות האנזימים שמייצרים אותם.
- עלייה בפירוק האנדוקנבינואידים בשל פעילות-יתר של FAAH אשר מפרק אנדוקנבינואידים בגופם.
אפשר לעזור לאנשים אשר סובלים מאי-תפקוד של המערכת האנדוקנבינואידית בעזרת CBD אשר מעכב את פעילות האנזים FAAH ובכך מעלה את רמות האננדמיד [AEA] במוח – או בעזרת THC אשר מפעיל את הקולטנים האנדוקנבינואידים במקום האננדמיד ושאר האנדוקנבינואידים שחסרים בדמם ובמערכת העצבים המרכזית וההקפית שלהם.
כדי לברר מי לוקה באי-תפקוד של המערכת האנדוקנבינואידית בשל הרקע התורשתי האישי אפשר לבדוק בדגימת רוק נוכחות של מוטציות נקודתיות בגנים [SNP] אשר מקדדים לחלבוני מטרה חשובים שונים. כאשר חלבון המטרה לא תקין – הטונוס של המערכת האנדוקנבינואידית נפגע. אפשר לבדוק את פעילות המוח בשיטות שונות [EEG PET או FMRI] לפני ובזמן צריכת קנביס, עם או בלי גירוי סביבתי. בעזרת שיטת PET ניתן להבחין בהתבטאות הקולטנים CB1 ו/או נוכחות אננדמיד בחלקי המוח השונים וגם את רמת הפעילות האנזים FAAH אשר מפרק אנדוקנבינואידים.
בבדיקת דם, חשוב לקבוע את רמת ההתבטאות של הקולטן CB2 על-פני קרומיות תאי B של מערכת החסון. גם מדידת רמות ציטוקינים שונים המסיסים בפלזמה שלהם תועיל לאבחון ההפרעה. מדידת ההתבטאות של האנזים FAAH על-פני טסיות הדם תאפשר אבחון מדויק של הטונוס הפנימי של המערכת האנדוקנבינואידית.
דר' יעקב וקסמן – 052-4114916